A maior parte dos pais são de estatura média, o que significa que precisam dos seus conhecimentos para se prepararem para as complicações multissistémicas causadas por um crescimento ósseo comprometido.4,17
A acondroplasia tem uma ocorrência de 1 em cada 25 000 nados vivos e afeta cerca de 250 000 pessoas em todo o mundo.1,2 A acondroplasia é o tipo de displasia esquelética mais frequente e representa cerca de 90% dos casos de estatura baixa desproporcional ou nanismo. Caracterizada por um crescimento ósseo endocondral comprometido, é causada por uma mutação com ganho de função no gene do recetor do fator de crescimento de fibroblastos 3 (FGFR3) e tem características físicas distintas:1,3-8
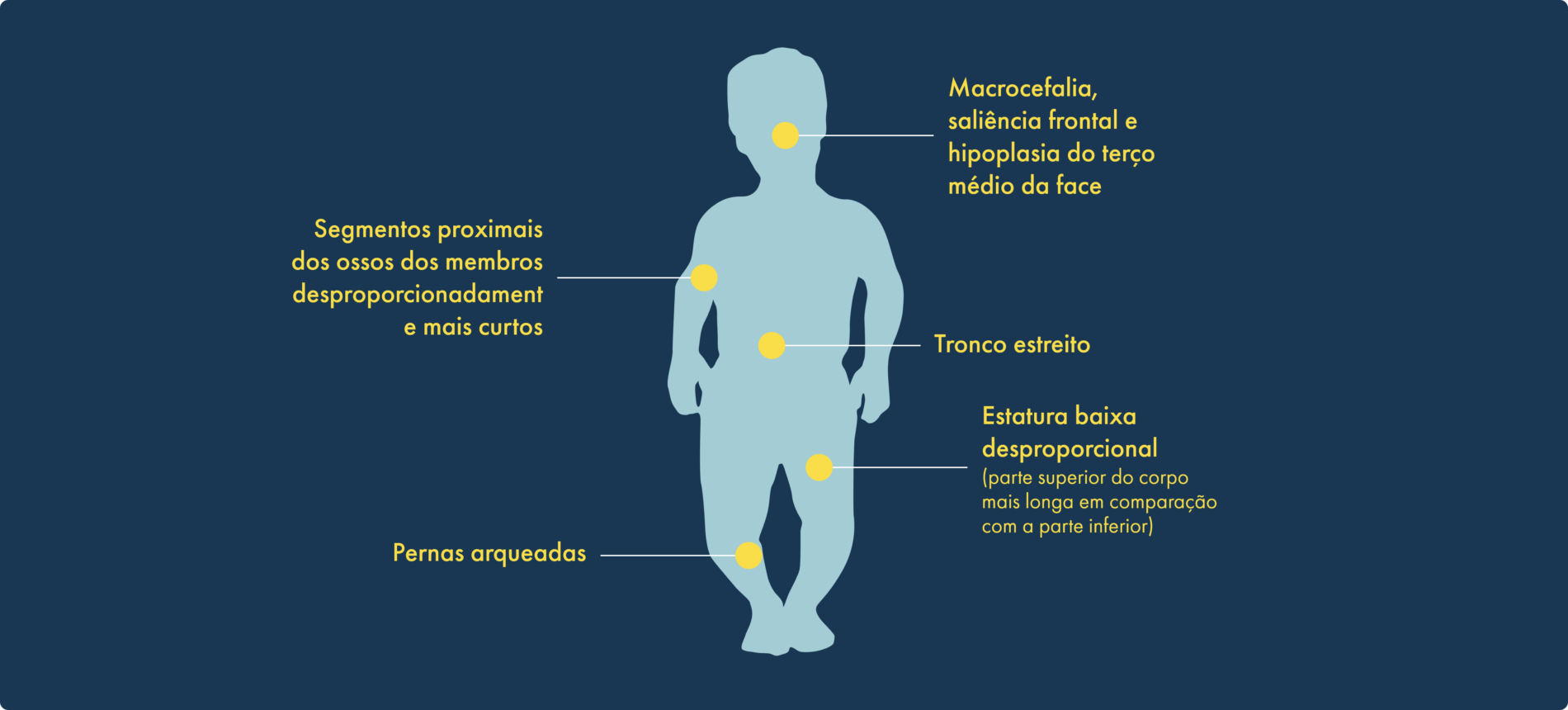
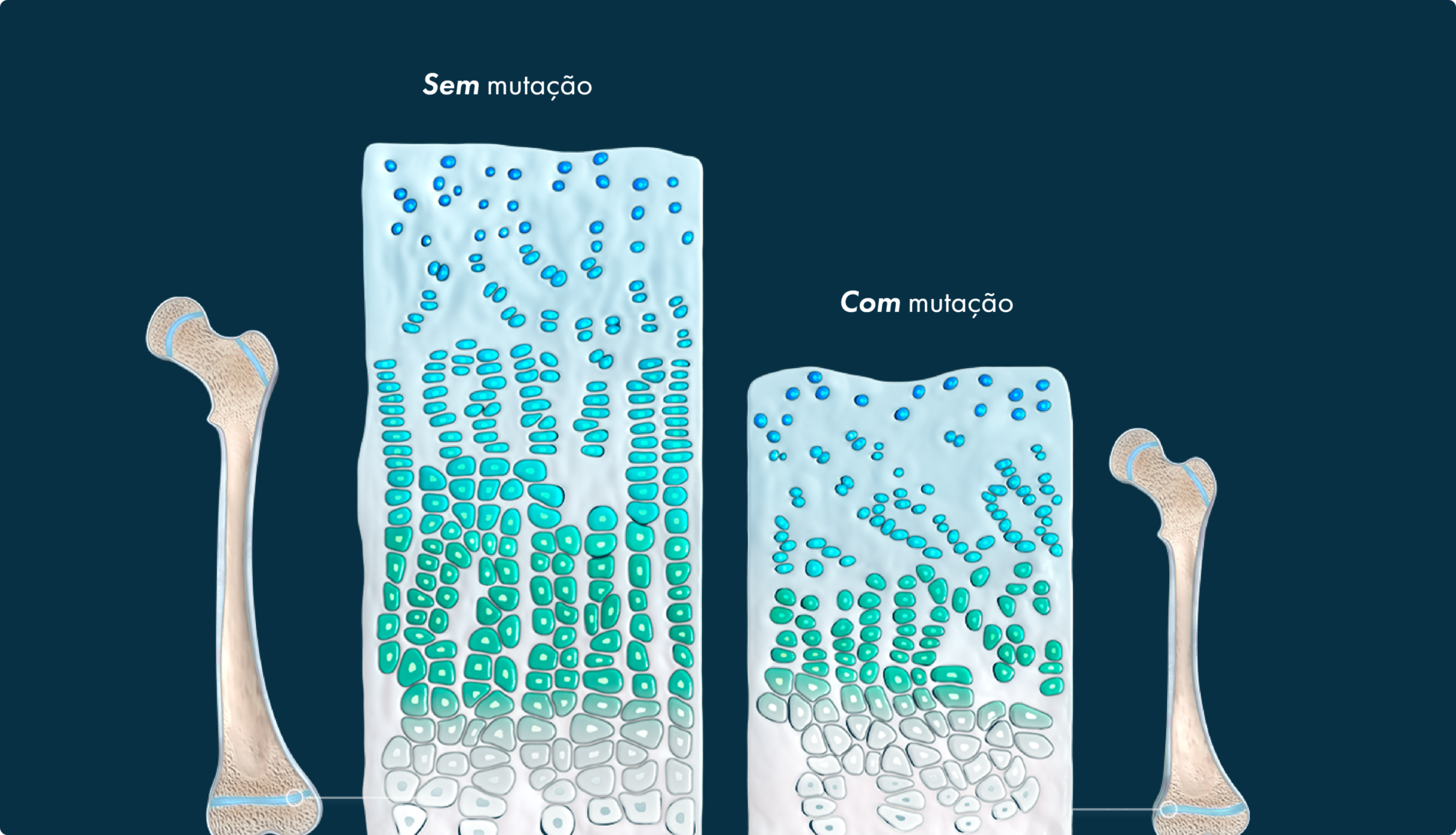
As características físicas, como a altura, são indicadores do crescimento ósseo por todo o corpo.
A ossificação endocondral — a substituição da cartilagem por osso – ocorre em todo o corpo e está implicada no desenvolvimento de cerca de 90% de todos os ossos. Este processo começa no útero e continua até ao início da idade adulta.10-12
Na ossificação endocondral, o precursor do osso futuro é a cartilagem
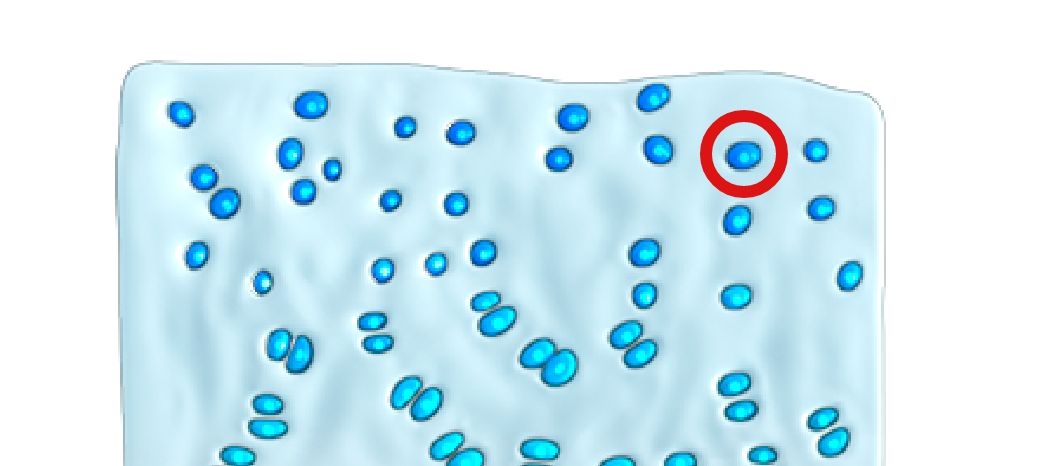
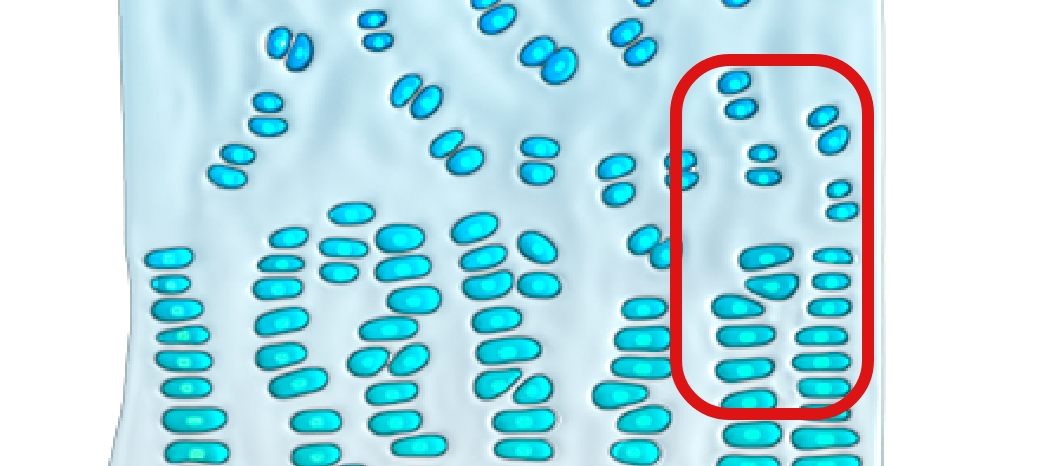
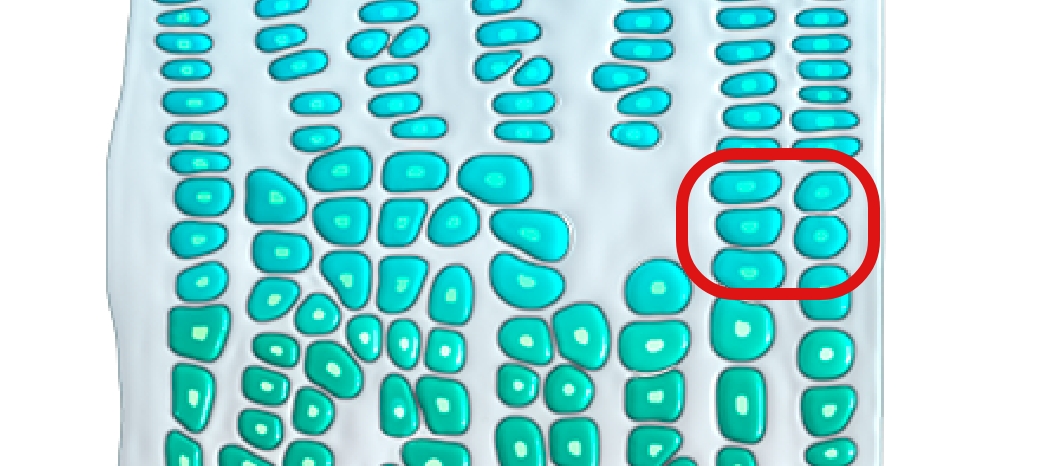
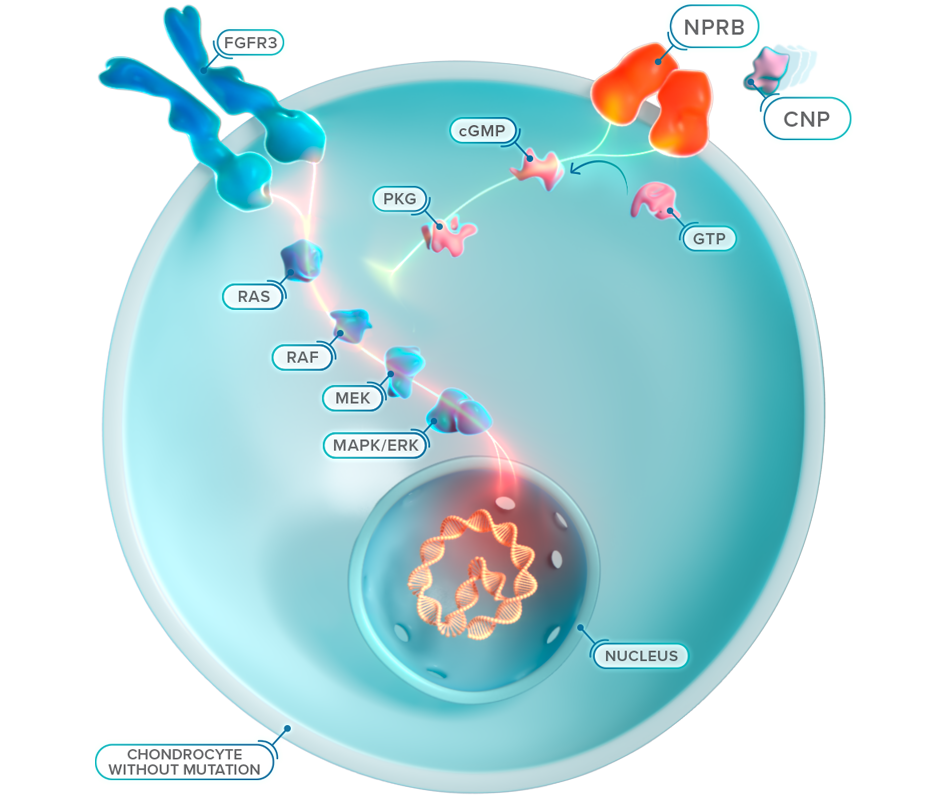
A mutação com ganho de função faz com que o FGFR3 gere sinais excessivos para abrandar o crescimento ósseo, sobrepondo-se à sinalização contrária proveniente da via do NPRB/CNP, o que resulta num crescimento ósseo comprometido.4,16
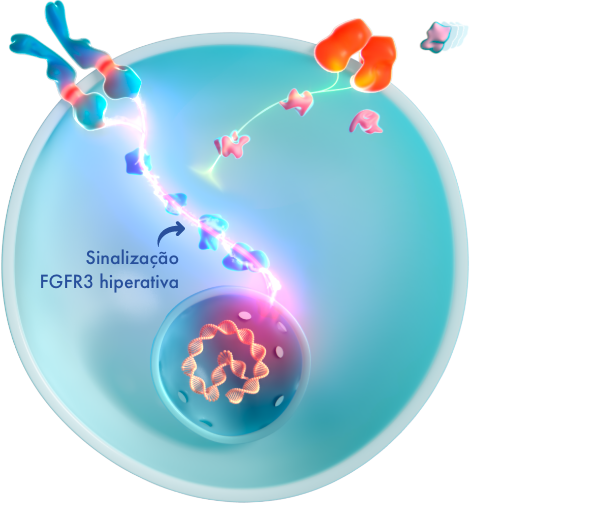
Isto origina um impacto multissistémico para o qual os pais poderão não estar preparados.
A maior parte dos pais são de estatura média, o que significa que precisam dos seus conhecimentos para se prepararem para as complicações multissistémicas causadas por um crescimento ósseo comprometido.4,17
A acondroplasia ocorre em aproximadamente _________ nados vivos em todo o mundo.

Complicações comuns da acondroplasia podem ser esperadas ao longo da vida de um indivíduo

Tudo que você precisa para aprofundar seu conhecimento sobre acondroplasia