La plupart des parents sont de taille normale. Ils ont donc besoin de votre expertise pour se préparer aux complications multisystémiques qui résultent de l’altération de la croissance osseuse.4,17
L’achondroplasie touche 1 enfant sur 25 000 naissances et concerne environ 250 000 personnes dans le monde.1,2 L’achondroplasia représente près de 90 % des cas de petite taille disproportionnée (ou nanisme). Elle se caractérise par une altération de la croissance osseuse endochondrale due à une mutation gain de fonction au niveau du gène FGFR3 (récepteur 3 du facteur de croissance des fibroblastes) et est associée à des caractéristiques physiques spécifiques:1,3-8
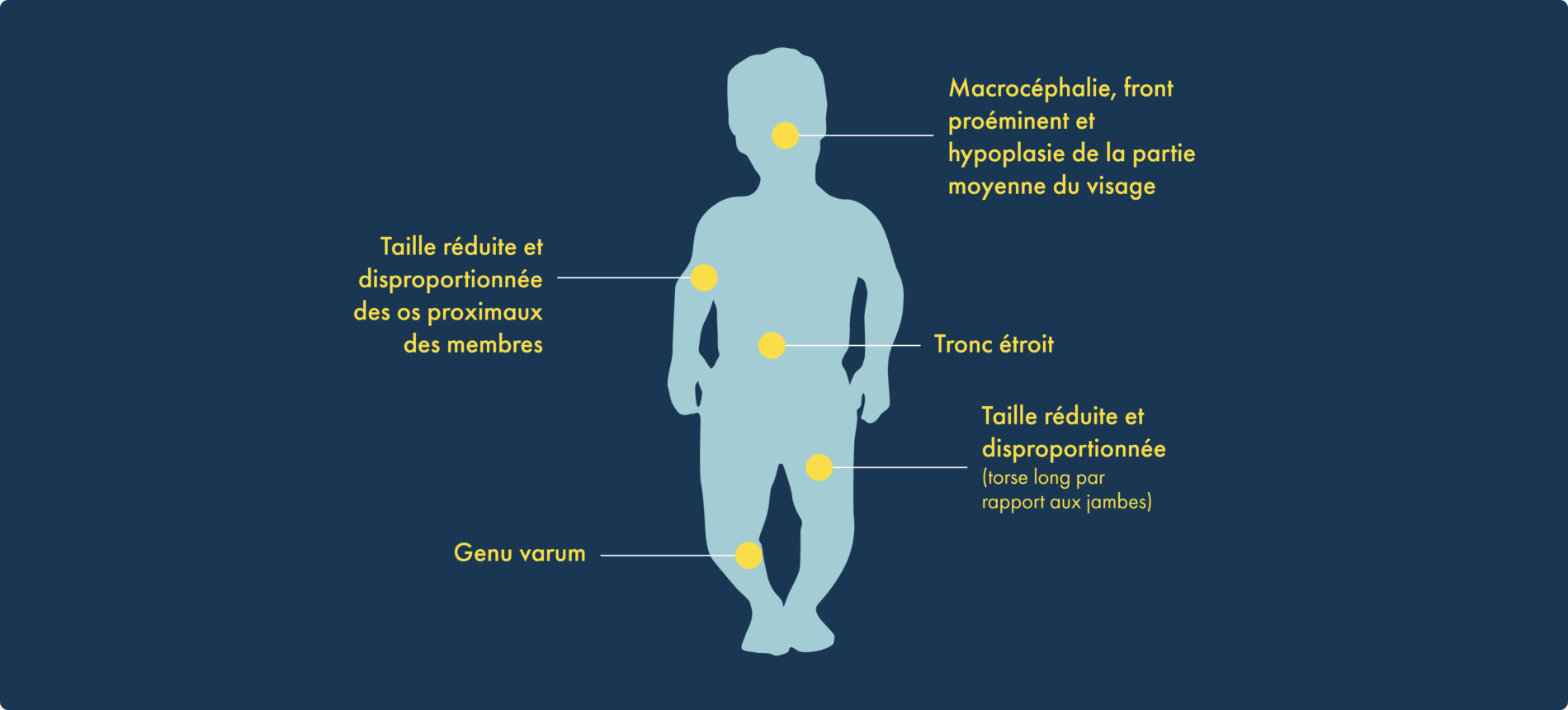
Certaines caractéristiques physiques, telles que la taille, sont des indicateurs de la croissance osseuse dans l’ensemble du corps
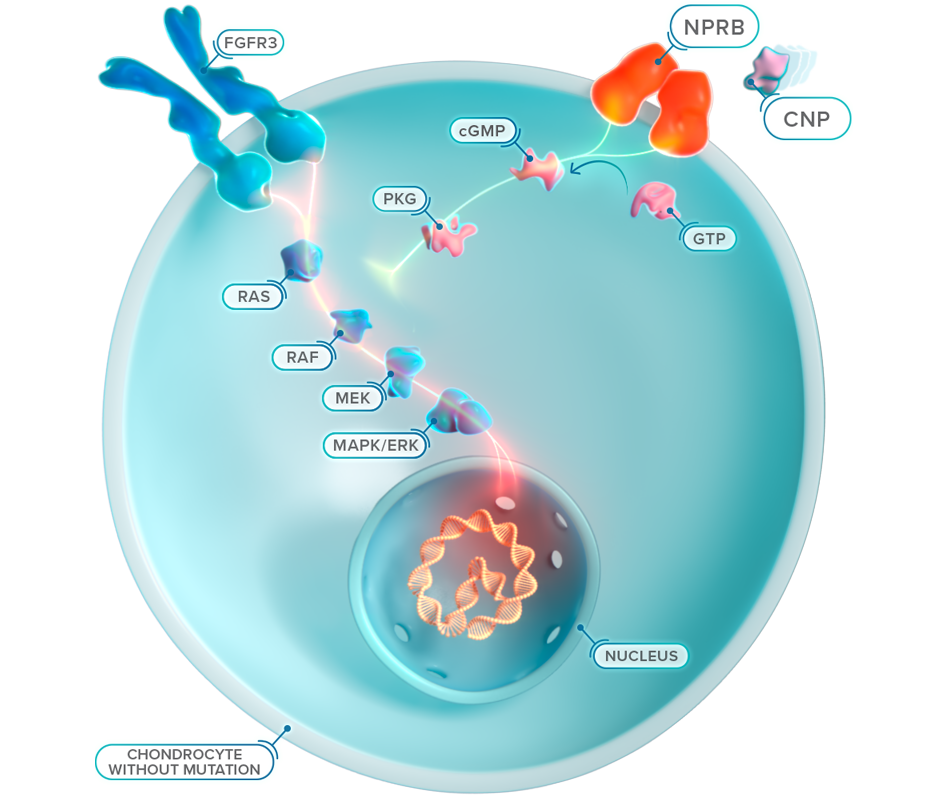
L’ossification endochondrale (remplacement du cartilage par de l’os) concerne l’ensemble du corps et intervient dans le développement de près de 90 % des os. Ce processus débute in utero et se poursuit jusqu’au début de l’âge adulte.10-12
Dans le processus d’ossification endochondrale, le précurseur de l’os est le cartilage
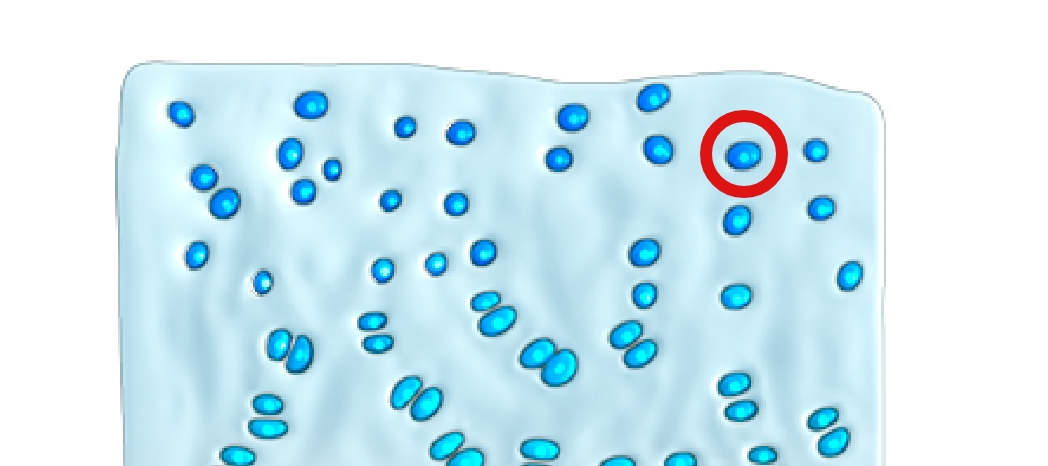
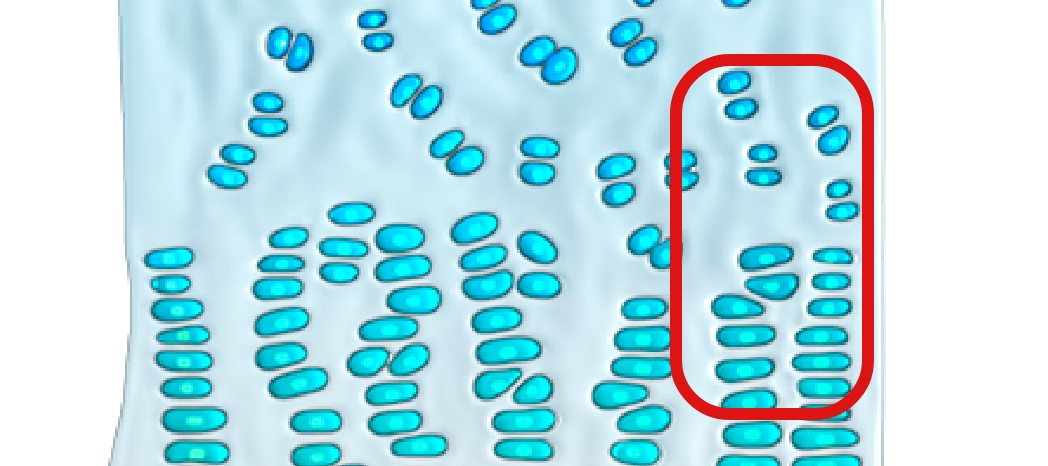
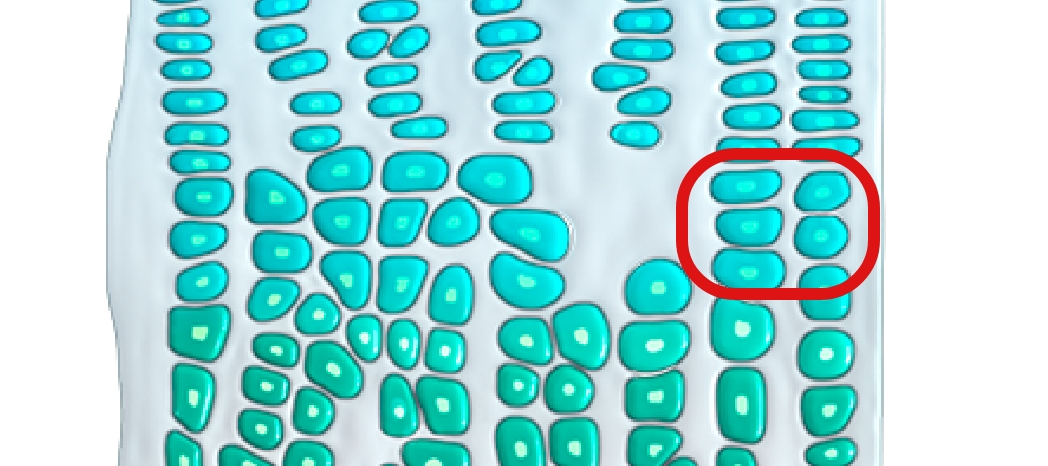
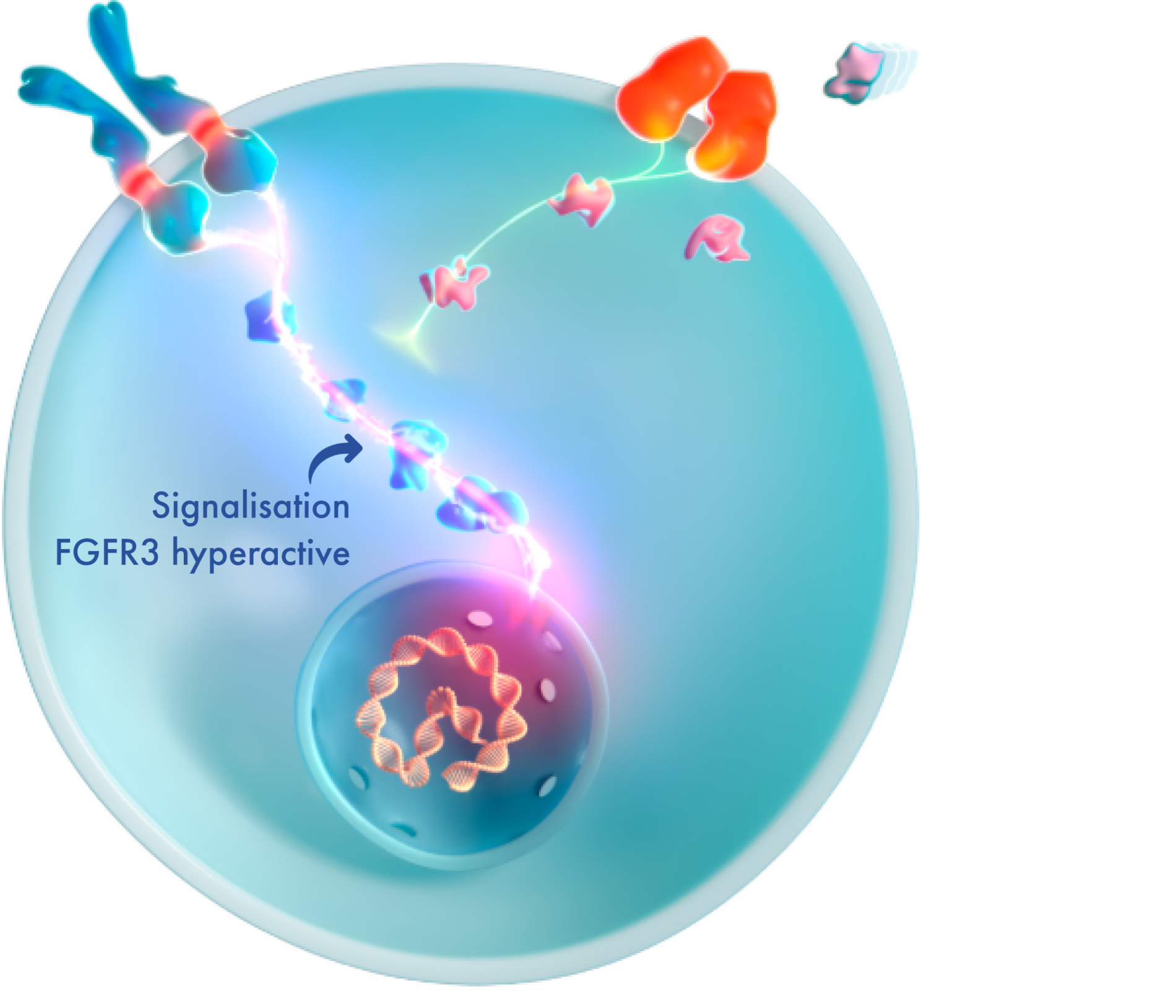
En raison d’une mutation gain de fonction, le récepteur FGFR3 produit de façon excessive des signaux visant à ralentir la croissance osseuse. Submergée par ces signaux, la voie NPRB/CNP n’est plus capable de les neutraliser, ce qui perturbe la croissance osseuse.4,16

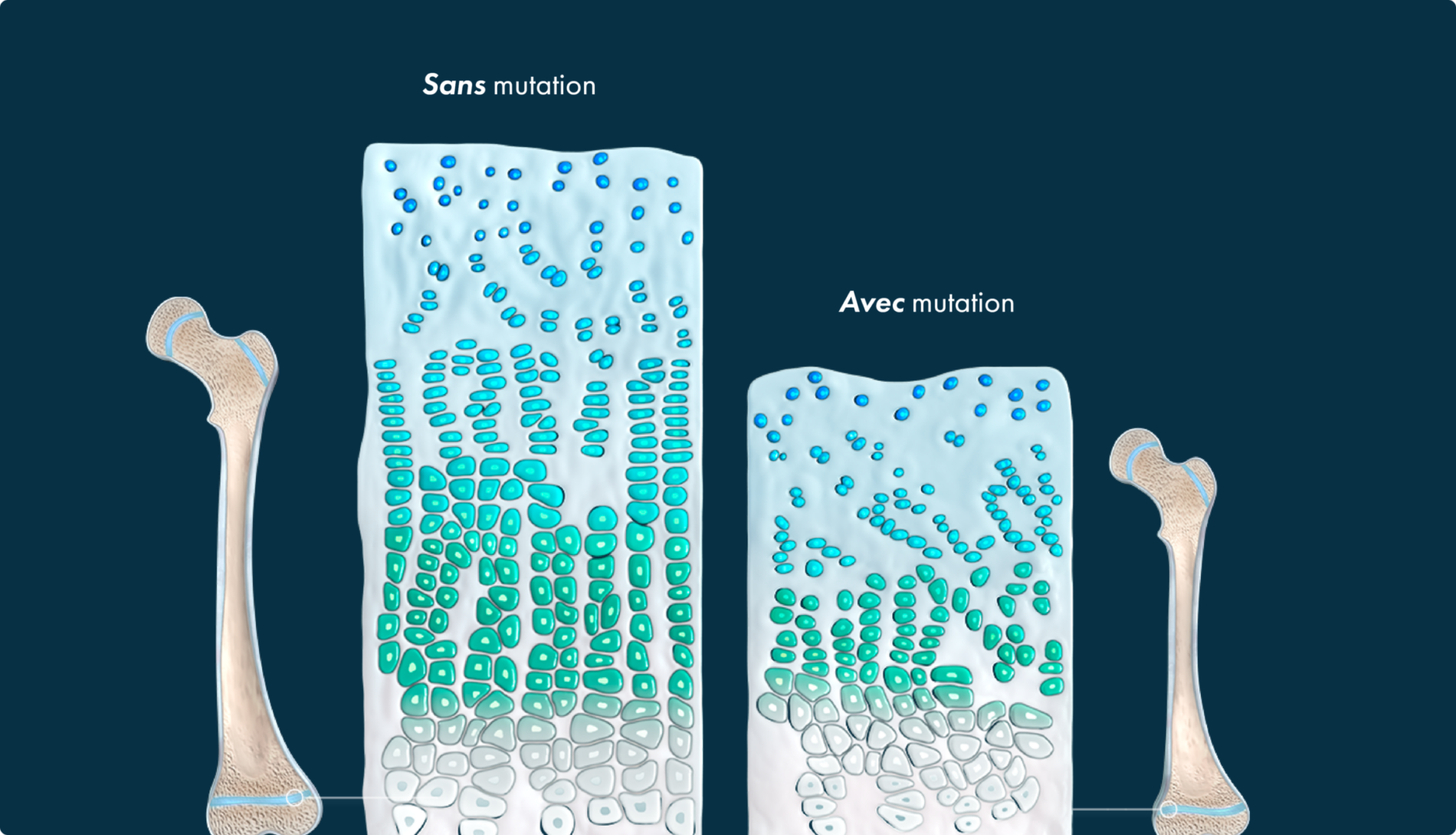
Les répercussions sont multisystémiques, et les parents n’y sont pas toujours préparés
La plupart des parents sont de taille normale. Ils ont donc besoin de votre expertise pour se préparer aux complications multisystémiques qui résultent de l’altération de la croissance osseuse.4,17
L’achondroplasie survient chez environ _________ naissances vivantes dans le monde.

Des complications courantes de l’achondroplasie peuvent être attendues tout au long de la vie d’un individu

Tout ce dont vous avez besoin pour approfondir vos connaissances sur l’achondroplasie